2023年1月26日,151amjs澳金沙门校友、四川大学华西医院生物治疗国家重点实验室石虎兵教授团队联合四川大学华西医院马学磊副教授在Cancer Cell发表研究论文Immune checkpoint HLA-E:CD94-NKG2A mediates evasion of circulating tumor cells from NK cell surveillance,发现了CTCs与NK细胞间新的免疫检查点分子对HLA-E:CD94-NKG2A,阐明了CTCs逃避宿主免疫监视的新机制,进而提出靶向免疫检查点HLA-E:CD94-NKG2A抑制肿瘤转移的治疗策略。

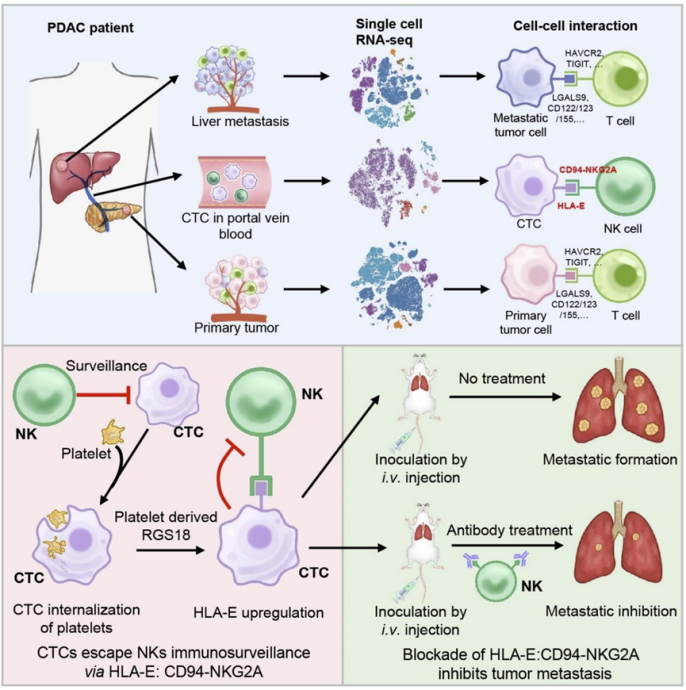
为了研究CTCs的转移机制,团队以胰腺导管癌(pancreatic ductal adenocarcinoma, PDAC)肝转移为模型,利用单细胞转录组测序技术刻画了PDAC原发灶肿瘤、CTCs和肝转移灶肿瘤微环境的转录普特征,基于CellPhoneDB分析了原发灶肿瘤细胞、CTCs和转移灶肿瘤细胞与免疫细胞间的相互作用,鉴定出CTCs与NK细胞间特异性的免疫检查点分子对HLA-E:CD94-NKG2A。并通过体内外实验,证明了利用anti-NKG2A的阻断抗体或者shHLA-E阻断该免疫检查点分子对的结合可有效的抑制肿瘤转移,表明HLA-E:CD94-NKG2A是CTCs与NK细胞间的一个新型的免疫检查点分子对。
进一步的分子机制研究发现,血小板来源RGS18通过AKT-GSK3β-CREB信号通路驱动CTCs中HLA-E的表达上调。有趣的是,该研究发现CTCs可以内吞血小板,并获得RGS18基因,从而帮助CTCs逃避NK细胞的免疫监视。这一发现颠覆了以往人们认为血小板黏附在CTC表面保护CTCs的认知,为研究血小板促进肿瘤转移提供了新的思路。
该工作的主要创新点包括:
(1)发现血液循环、原发灶和转移灶肿瘤微环境中肿瘤细胞与免疫细胞间的相互作用显著不同。
(2)发现CTCs通过免疫检查点分子对HLA-E:CD94-NKG2A逃避宿主免疫监视的新机制。
(3)证实了阻断免疫检查点HLA-E:CD94-NKG2A可抑制肿瘤转移,为治疗肿瘤转移提供了新的靶点。
(4)发现CTCs通过内吞血小板获得RGS18基因,上调免疫检查点HLA-E的表达,从而逃避NK细胞免疫监视。
四川大学华西医院刘小伟助理研究员、四川大学生物治疗国家重点实验室博士研究生宋金恩、刘馨雨和四川大学华西医院张浩副教授为文章的共同第一作者,四川大学生物治疗国家重点实验室石虎兵教授和四川大学华西医院生物治疗科马学磊副教授为通讯作者。
消息来源:BioArt 微信公众号
石虎兵教授简介

石虎兵,2001年毕业于151amjs澳金沙门(本硕连读制),获硕士学位;2007年毕业于清华大学,获得博士学位(清华大学优秀博士论文,并获全国优秀博士论文提名);后在美国加州大学洛杉矶分校从事肿瘤分子靶向治疗及耐药性机理研究。四川大学华西医院生物治疗国家重点实验室教授,博士生导师,国家“十三五”重点研发计划“精准医学研究”项目负责人,国家高层次青年人才。主要通过多维组学技术,从事肿瘤MAPK通路分子靶向和PD-1-PD-L1免疫检测点抑制剂的精准个体化治疗机理研究。研究期间共发表学术论文50余篇,影响因子超过1000,被引用9000余次,以第一作者或通讯作者(含共同)身份在Nature、Cell、Cancer Discovery(3篇)、Cancer Cell、Signal Transduction and Targeted Therapy、Nature Biomedical Engineering、Nature Communications、Blood(封面文章)等著名期刊发表论文20余篇。